مقدمة عن الماء
يُعد الماء أساسياً لاستمرار الحياة، فلا حياة ولا وجود بدون الماء وهو المادة الوحيدة على كوكب الأرض التي تتواجد طبيعياً بحالاتها الثلاثة؛ الصلبة والسائلة والغازية.
ولهذا السبب فإن العلماء والفلكيون يبحثون دائماً عن الماء في الفضاء الخارجي لمعرفة احتمالات وجود حياة على كواكب أخرى.
وهذه من أهم المسائل التي تشغل عقول العلماء في عصرنا الحالي، وكثيرا ما يتحمس العلماء على إيجاد الماء خاصة إذا كان سائلاً.
ولهذا السبب اندهشنا في شهر ديسمبر من عام 2012 عندما عصر مسبار امبورتنت importent على قناة جبسية يبلغ طولها 12 إنش تكونت على الأرجح نتيجة لوجود الماء السائل إلى سطح المريخ قبل مليارات السنين.
لذلك من الصعب معرفة فيما إذا كان وجود هذا الماء دليلاً على وجود حياة على هذا الكوكب، وربما سنتمكن المستقبل من اكتشاف ذلك وسيكون ذلك أمر مذهلاً.
وفي آية قرانيه عن الماء يقول الله -تعالى- في سورة الأنبياء (وجعلنا من الماء كل شيء حي).
لذلك؛ سنقدم لكم هنا بحث عن الماء في غاية الأهمية ويشتمل على قدر كبير من المعلومات والتعريفات التي ستُثري عقلك ومحتوى ذهنك.
خصائص الماء
يُعتبر وجود الماء دليلاً على وجود الحياة لعدة أسباب مختلفة، ولمعرفة ذلك يجب أولاً معرفة الخصائص المميزة للماء، ولنتمكن من ذلك، سنتعرف على جزيء الماء، وهو من أشهر الجزيئات في العالم. كما أنه مألوف بالنسبة للجميع.
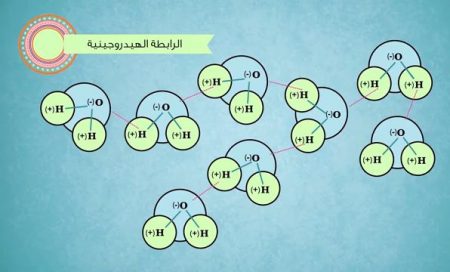
جزيء الماء H2O يتكون من ذرتين هيدروجين وذرة أكسجين، وتتشارك ذرتي الهيدروجين بإلكترون واحد مع ذرة الأكسجين بعلاقة تُسمى الرابطة التساهمية.
وعندما تقومون برسم جزيء الماء ستلاحظون أنه يظهر على شكل حرف V.
ولأن ذرة الأكسجين هي الأكثر حاجة للإلكترونات؛ فإنها تحمل شحنة جزئية سالبة.
أما المنطقة التي فيها ذرتا الهيدروجين فتحمل شحنة جزئية موجبة، ونتيجة لهذه القبطية فإن جزيئات الماء تنجذب لبعضها البعض حتى تتلاصق ببعضها، وهذا ما يسمى بـ: الروابط الهيدروجينية.
وما يحدث في هذه الروابط هو ارتباط القطب الموجب عدد ذرات الهيدروجين مع القطب السالب عند ذرة الأكسجين في جزيء ماء آخر.
هذه الروابط ليست ضعيفة، وما من مبالغة على التأكيد على أهمية هذه الروابط الهيدروجينية، فالروابط الهيدروجينية هي أهم شيء بالنسبة للماء.
خصائص الروابط الهيدروجينية
خاصية التماسك
هي من أهم الخصائص الناتجة عن الروابط الهيدروجينية لدي الماء، والتي تؤدي إلى التوتر السطحي العالي.
لذلك؛ فإن التماسك هو الانجذاب بين جزيئين من النوع نفسه؛ مثل انجذاب جزيء ماء إلى جزيء ماء آخر.
والماء يعتبر من أكثر السوائل الفلزية تماسكاً، ويمكن ملاحظة ذلك إذا وضعتم بعض الماء على ورق الشمع أو أي سطح ناعم.
فتتماسك هذه القطرات مع بعضها، وربما يتم ذلك في قطرات الماء على ورق الشجر.
وبما أن قوة التصاق قطرات الماء بورق الشمع أو ورق الشجر تكون أضعف من قوة ترابط جزيئات الماء ببعضها، فتتجمع جزيئات الماء مع بعضها لتشكيل قطرات لديها أصغر مساحة سطحية ممكنة.
وهذا التوتر السطحي المرتفع للماء يسمح لبعض الحشرات، أو ربما أحد أنواع السحالي بالمشي على الماء.
خاصية الالتصاق
لقوة تماس الماء حدود معينة، فهناك مواد أخرى يحب الماء الالتصاق بها مثل الزجاج، وهذه الخاصية تُسمى الالتصاق. وعندما وضع الماء على الزجاج ترون أنه ينتشر على الزجاج بدلاً من التجمع في قطرات.
وذلك لأن قوة الالتصاق بين الماء والزجاج أكبر من قوة التماسك بين جزيئات الماء بين بعضها.
الالتصاق هو الانجذاب بين مادتين مختلفتين، وهو ما نراه في حالة الانجذاب بين جزيئات الماء وجزيئات الزجاج. هاتان الخاصيتان للماء تُعطيان القدرة على تحدى الجاذبية، وهذا ما يُسمى ب الخاصية الشعرية.
الخاصية الشعرية
تُعرف هذه الخاصية بناءً على معرفتنا بخاصيتي التماسك والالتصاق، ونتيجة لخاصية الالتصاق ستنجذب جزيئات الماء إلى جزيئات الأنبوب الزجاجي، وعند التصاق جزيئات الماء بالانبوب سيتبعها المزيد من جزيئات الماء؛ بسبب تماسك جزيئات الماء ببعضها.
فالتماسك هو الذي جعل ذلك ممكناً، والتوتر السطحي الناشئ يؤدي إلي ارتفاع الماء في الأنبوب الزجاجي، وسيستمر بالارتفاع إلى أن توقفه قوة الجاذبية عندها تغلب وزن الماء في الأنبوب على قوة التوتر السطحي فيه.
الماء مُذيب عام
إن قطبية جزيء الماء تمكنه من إذابة الأشياء؛ لذلك يمكننا القول أنه مذيب جيد. كما أنه ليس مذيباً جيداً فحسب، بل هو مُذيب ممتاز.
عدد المواد التي يمكن أن تذوب في الماء أكثر من أي سائل الآخر على الأرض. بما في ذلك أقوى الأحماض التي تم تصنيعها.
المواد المُحبة للماء
تُسمى المواد التي تذوب في الماء؛ مثل السكر والملح مواد محبة للماء. وهي محبة للماء لأن جزيئاتها قطبية، وتكون قطبيتها أقوى من قوة تماسك جزيئات الماء.
وعندما إذابة إحدى هذه المواد القطبية في الماء؛ فإنها تُضعف قوة التماسك بين جزيئات الماء، أي الروابط الهيدروجينية بينها.
وبدلاً من تكوين هذه الروابط من خلال ارتباط الهيدروجين ببعضه، سيرتبط الماء مع جزيئات المادة القطبية المذابة.
على سبيل المثال؛ ملح الماء إذا هو مركب أيوني، وعند إذابته في الماء يتفكك إلى أيونات، فإن أقطاب جزيئات الماء تتفاعل معه.
المواد الكارهة للماء
ماذا يحدث عند عدم قدرة جزيء ما على إضعاف قوة التماسك بين جزيئات الماء واختراقها والدخول فيما بينها؟
أي ماذا يحدث عندما لا تتمكن مادة معينة من التغلب على قوة التماسك بين جزيئات الماء ولا يمكنها الذوبان في الماء؟
تسمى هذه الحالة المواد الكارهة للماء، أو المواد الصادة للماء. تتميز جزيئات هذه المواد بأقطار شحنة ضعيفة، فتكون هذه الجزيئات لا قطبية.
وبالتالي لا تذوب في الماء؛ وذلك لأن قوى تماسك الماء تطردها خارجه.
قد يكون الماء مُذيباً جيداً لكثير من المواد، ولكن لا يعني ذلك أنه قادرُ على إذابة كل شيء.
العالم هنري كافنديش
هناك العديد من العلماء غريبي الأطوار على مر التاريخ، ومن أغرب هؤلاء العلماء العالم هنري كافنديش الذي كان غريباً في تواصله مع العاملين في منزله.
إذ تواصل معهم عبر كتابة الملاحظات، وبنى سلماً إضافياً خلف منزله ليتفادى الاحتكاك بهم.
اعتقد البعض أن ذلك نتيجة لإصابته بمرض التوحد. لكن جميع من حوله أقرّ بأنه عالم عبقري.
حيث اشتهر لكونه أول من اكتشف غاز الهيدروجين كمادة متميزة، إضافة إلى تحديده لتركيب الماء.
وفي القرن الثامن عشر كان الناس يعتقدون أن الماء عنصر منفرد بذاته، ولكن كافنديش لاحظ أن الهيدروجين الذي اسماه بالهواء القابل للاشتعال يتفاعل مع الأكسجين الذي كان يعرف بالهواء الخالي من الفلوجستون لتكوين الماء.
لم يدرك Henry Cavendish أهمية اكتشافه، ويعود ذلك إلى أنه لم يقتنع بوجود المركبات الكيميائية. بل فصل تجاربه بأن الهيدروجين هو عنصر كالنار يُسمى الفلوجستون. ومع ذلك كانت تجاربه رائدة ومؤثرة، ومنها تجاربه في تحديد الكثافة النوعية، والكثافة النسبية للهيدروجين والغازات الأخرى بالنسبة إلى الهواء العادي.
قد تدركون مدى عبقريته إذا أخذتم بعين الاعتباري بساطة الأدوات التي كان يستخدمها، ومنها الجهاز الذي استخدمه لإنتاج الهيدروجين.
هذا بالإضافة إلى اكتشافه لتركيب الغلاف الجوي، واكتشاف كثافة الأرض.
وذلك ليس سيئاً بالنسبة لرجل كان شديد الخجل لدرجة أن اللوحة الوحيدة له رسمت دون علمه.
وبالرغم من تجاربه العديدة على مر العقود إلا أنه لم ينشر سوى 20 بحثاً.
وبعد وفاته بسنوات أدرك الباحثون أن كافنديش سبق واكتشف قانون ريختر، وقانون أوم، وقانون كولوم، وعدة قوانين أخرى.
ولكنها لم تعرف آنذاك، ولو نسبت هذه القوانين إليه لأصبحت أسماء هذه القوانين قانون كافنديش الأول وقانون كافنديش الرابع وهكذا.
لماذا يُعد الماء المجمد أقل كثافة من الماء السائل؟
يطفو الماء على السطح في حالته الصلبة، بالرغم من أن كل المواد الأخرى تكون في حالتها الصلبة أكثر كثافة من حالتها السائلة. وكذلك تكون الغازات أقل كثافة من السوائل.
أما هذه الميزة في الماء التي تجعله يطفو في حالته الصلبة هي أحد الأسباب التي تجعل الحياة ممكنة على هذا الكوكب.
ولكن ما السبب في أن كثافة الماء الصلب أقل كثافة من الماء السائل على عكس جميع المواد الأخرى؟
السبب في ذلك يعود إلى الروابط الهيدروجينية بين جزيئاته، إذاً أنه عند درجة حرارة 32 فهرنهايت أو صفر درجة مئوية إذا كنت تعيش في الدول التي تستخدم النظام المئوي في قياس درجة الحرارة تبدأ جزيئات الماء بالتحول إلى الحالة الصلبة.
وتُشكل الروابط الهيدروجينية بين جزيئات الماء بُنية بلورية، كما يباعد بين الجزيئات أكثر ويصبح الماء المجمد أقل كثافة من الماء السائل.
وفي معظم المواقف فإن طوفان الثلج في الماء هو شيء إيجابي، فإذا كان الثلج أكثر كثافة من الماء السائل، فإن الماء سيتجمد وينزل إلى الأسفل، ثم يتجمد وينزل إلى الأسفل، ثم يتجمد وينزل مرة أخرى، وبالطبع هذا ليس بالأمر الجيد.
فالحياة على الأرض ستكون أصعب بكثير، لأن هذا لن يدمر فحسب الأرض والبيئية المائية التي أدت إلى إيجاد الحياة على الأرض.
بل سيتسبب في غرق القطب الشمالي المتجمد، مما سيؤدي إلى فيضان المياه في البحار والمحيطات حتى تُغطي اليابسة بأكملها مما سيجعل الحياة على الأرض صعبة.
السعة الحرارية للماء
وهي من أهم خصائص الماء، حيث يمتلك الماء سعة حرارية مرتفعة، ومن المحتمل أنكم لا تعرفون معنى ذلك.
ما يعنيه ذلك أن الماء يحتفظ بالحرارة جيداً، ولهذا السبب نضع قربة الماء الساخن في السرير للحصول على الدفء في الشتاء.
بالإضافة إلى تدفئة السرير تساعد هذه الخاصية في منع تسخين وتبريد مياه المحيطات بسرعة. حيث تمتص المسطحات المائية الحرارة، وتنظيم درجة الحرارة والمناخ على كوكبنا.
ولهذا السبب يكون الجو في لوس انجلوس الواقعة على المحيط الذي ينظم درجة الحرارة ألطف بكثير من الجو في ولاية مثل نبراسكا.
يُمكنكم ملاحظة فائدة خاصية السعة الحرارية بسهولة إذا وضعتهم إبريق فارغاً على الموقد سيتضرر الإبريق بشكل كبير.
أما إذا وضعتم فيه بعض الماء فسوف يستغرق الماء وقتاً كبيراً حتى يغلي. وإذا لم تلاحظوا ذلك، ربما لاحظتم أن تبخر الماء من جلدكم يعمل على تخفيض حرارتكم، وهذا هو مبدأ التعرق الذي يُعد في غاية الأهمية، بالرغم من الاحراج الذي قد يسببه.
وهذه من الخصائص الأخرى التي يمتاز بها الماء، فحين ترتفع حرارة الجسم، ويتعرق تُثير الحرارة جزيئات الماء على البشرة إلى أن تتكسر الروابط الهيدروجينية بينها فتتبخر الجزيئات، وتبتعد حاملة معها الطاقة الحرارية من الجسم مما يبرد الجسم.