
بطاقة الدرس:
- عنوانه: الجدول الدوري وخصائص العناصر.
- ترتيبه: الثاني من الوحدة الثانية «الذرّة والجدول الدوري».
- مادة: العلوم.
- الصف: الثامن الأساسي.
- الفصل الدراسي: الأول.
- المدارس: الأردنية.
- الهدف: تلخيص/مراجعة وحل أسئلة.
- الدرس السابق: تركيب الذرة والتوزيع الالكتروني
لتسهيل دراسة العناصر، حاول العلماء تصنيفها، فرتّبوها في مصفوفة منظمة أطلقوا عليها اسم الجدول الدوري.
ومع تزايد أعداد العناصر المكتشفة، لاحظ العلماء وجود أوجه تشابه بين هذه العناصر من ناحية خصائصها، سواء الفيزيائية أم الكيميائية، وهذا ما تطلب تنظيمها وتصنيفها.
فكانت هناك الكثير من المحاولات من أهمها:
الجدول الدوري لمندليف: في عام 1869م نشر العالم الروسي دمتري مندليف نسخته الأولى من جدوله الدوري الذي رتبت فيه العناصر وفقاً لتزايد أعدادها الكتلية.
هنري موزلي: في بداية القرن العشرين، طوّر العالم الإنجليزي جدول مندليف الدوري وتحسينه، رتبت العناصر فيه وفقاً لتزايد أعدادها الذرية بدلاً من أعدادها الكتلية.
الجدول الدوري الحديث: رتبت العناصر فيه وفقاً لتزايد أعدادها الذرية، وقد تم ترتيب العناصر في الجدول الدوري الحديث استناداً إلى ثلاث أسس:
- رُتبت العناصر حسب ازدياد العدد الذري.
- رتبت العناصر في صفوف أفقية سمّي كل صف منها دورة Period؛ على أن تتغير خصائص العناصر في الصف الواحد تغيراً تدريجياً يمكن توقعه.
- رُتبت العناصر في أعمدة سمّي كل عمود منها مجموعة Group، على أن تتشابه العناصر الموجودة في العمود الواحد في خصائصها الفيزيائية والكيميائية.
عندما تتفحص الجدول الدوري ستجد أنّه ملون بألوان مختلفة تمثل العناصر إلى فلزات ولافلزات وشبه فلزات (لاحظ موقعها في الجدول الدوري وما علاقة رقم المجموعة في ذلك).
الدورات والمجموعات في الجدول الدوري
الدورات في الجدول الدوري
تنتظم العناصر في الجدول الدوري ضمن صفوف أفقية تسمى دورات، وعددها سبع دورات.
تضم الدورة الأولى عنصران هما الهيدروجين H، والهيليوم He. ونظراً إلى أن مستوى الطاقة الأول يتسع لإلكترونين فقط، فسيكون مستوى الطاقة الخارجي لذرة الهيليوم مكتملاً، وأي ذرة يكون مستواها الخارجي. مكتملاً توصف بأنها مستقرة، أي إن الهيليوم يعدّ عنصراً مستقراً.
والدورة الثانية تشمل ثمانية عناصر تبدأ من الليثيوم Li وتنتهي بالنيون Ne الذي يحتوي على 10 إلكترونات، فمستوى الطاقة الأول يتسع لإلكترونين، و 8 إلكترونات في مستوى طاقته الخارجي.
فالتوزيع الإلكتروني لعناصر هذه الدورة ينتهي في مستوى الطاقة الثاني الذي يتسع لـ 8 إلكترونات في حده الأقصى، فهذا يعني أن مستوى الطاقة الخارجي مكتمل وممتلئ بالإلكترونات، وعندئذٍ توصف الذرة بأنها مستقرة، أي إن النيون عنصر مستقر أيضاً.
والأمر نفسه في الدورة الثالثة، حيث تبدأ هذه الدورة بعنصر الصوديوم Na وتنتهي بعنصر الأرجون Ar.
إن عدد المستويات الموجودة حول نواة العنصر هي التي تحدد رقم الدورة (الصف) التي يوجد فيها العنصر.
المجموعات في الجدول الدوري
عندما تتفحص الجدول الدوري مرة أخرى، ستجد أنّه يتكون من (18) عموداً، ويتكون كل عمود من مجموعة أو عائلة من العناصر، وأن عناصر المجموعة الواحد تتشابه في خصائصها الفيزيائية والكيميائية.
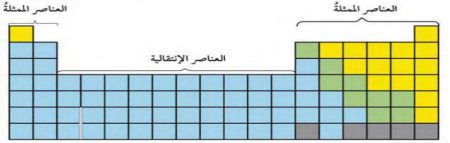
ويبين الشكل التالي مناطق الجدول الدوري، وتتضمن المنطقة الأولى التي تسمى مجموعة العناصر الممثلة، المجموعتين الأولى والثانية، والمجموعات من 13 إلى 18.
أما العناصر التي توجد في المجموعات من 3 إلى 12 فتسمى مجموعة العناصر الانتقالية.
| عناصر المجموعة الأولى (القلويات) | خصائصها |
| ليثيوم Li | صلبة ونشطة في تفاعلاتها تحتوي على إلكترون واحد في مستوى طاقتها الخارجي تسمى مجموعة القلويات لها خصائصها الفيزيائية |
| صوديوم Na | |
| بوتاسيوم K | |
| روبيديوم Rb |
| عناصر المجموعة الثانية (القلويات الترابية) | خصائصها |
| بريليوم Be | صلبة تحتوي على إلكترونين في مستوى طاقتها الخارجي تسمى مجموعة القلويات الترابية لها خصائصها الفيزيائية |
| مغنيسيوم Mg | |
| كالسيوم Ca | |
| باريوم Ba |
ويتضمن العمود الثالث من العناصر الممثلة أو العمود 13 من الجدول الدوري عناصر المجموعة الثالثة أو الثالثة عشرة التي تبدأ بعنصر البورون (B) وتحته عنصر الألمنيوم (13Al)، وعناصر هذه المجموعة فلزات صلبة، ما عدا البورون الذي هو شبه فلز أسود اللون وهش، وتحتوي على ثلاثة إلكترونات في مستوى طاقتها الخارجي، وهكذا.
ويتضمن العمود الرابع من العناصر الممثلة أو العمود 14 من الجدول الدوري عناصر المجموعة الرابعة أو الرابعة عشرة التي تبدأ بعنصر الكربون (4C) وتحته عنصر السليكون (14Si)، وعناصر هذه المجموعة يمكن أن تكون فلزات أو لافلزات أو أشباه فلزات، وتحتوي على أربعة إلكترونات في مستوى طاقتها الخارجي، وهكذا.
أما الأعمدة من الخامس إلى السابع من العناصر الممثلة أو الأعمدة من الخامس عشر إلى السابع عشر من الجدول الدوري تتضمن عناصر المجموعات الخامسة أو الخامسة عشرة، إلى المجموعة السابعة أو السابعة عشرة على التوالي، وعناصر هذه المجموعات يمكن أن تكون لافلزات أو أشباه فلزات، وتحتوي على خمسة إلكترونات وستة وسبعة على التوالي في مستوى طاقتها الخارجي، وهكذا.
نلاحظ مما سبق أنّ كل مجموعة من المجموعات المرتبة في أعمدة في الجدول الدوري تحتوي على عناصر لها العدد نفسه من الإلكترونات في مستوى طاقتها الخارجي، لذا فهي متشابهة في خصائصها الكيميائية.
ونستنتج أن عدد الإلكترونات الموجودة في مستوى الطاقة الخارجي لأي عنصر هي التي تحدد رقم المجموعة التي يقع فيها هذا العنصر. الكترونات التكافؤ عدد الإلكترونات الموجودة في مستوى الطاقة الخارجي لأي عنصر.
أكمل الجدول (ص 71):
| العنصر | رمزه | عدده الذري | التوزيع الإلكتروني | عدد مستويات الطاقة | الدورة التي يقع فيها | عدد الكترونات التكافؤ | المجموعة التي يقع فيها |
| الليثيوم | 3 | ||||||
| الكربون | 6 | ||||||
| النيون | 10 | ||||||
| المغنيسيوم | 12 | ||||||
| الكلور | 17 | ||||||
| الأرجون | 18 |
تكوّن الأيونات Ions Formation
الذرات المستقرة: هي تلك الذرّات التي يكون مستوى طاقتها الخارجي ممتلئاً بالحد الأقصى من الإلكترونات؛ لذا فالذرّات ليست جميعها مستقرة؛ لأن بعضها لا يمتلك مستوى طاقة خارجياً مكتملاً وممتلئاً بالإلكترونات.
تسمى الذرات التي تقع في المجموعة 18 في الجدول الدوري بالغازات النبيلة أو الخاملة، وسميت بذلك لأنها هي فقط التي تمتلك مستويات طاقة خارجية مكتملة وممتلئة بالإلكترونات، فهي بذلك عناصر مستقرة ولا تميل للتفاعل، مثل عنصر الهيليوم 2He : 2، وعنصر النيون 8 , 2 : 10Ne وعنصر الآرجون 8 , 8 , 2 : 18Ar وعنصر الكربتون 8 , 18 , 8 , 2 : 36Kr.
إن الوصول لحالة الاستقرار يعني الوصول إلى توزيع إلكتروني مشابه للتوزيع الإلكتروني للغازات النبيلة ويحدث هذا الاستقرار للذرات؛ عندما تفقد هذه الذرات الإلكترونات أو تكتسبها، أو تُشارك فيها، فعندما تفقد أي ذرة إلكترونات من مستوى طاقتها الخارجي، أو تكتسبها تكوّن ما يسمى الأيون lon.
ويمكن أن تكون الأيونات المتكونة موجبة بسبب فقدانها الإلكترونات أو سالبة بسبب اكتسابها للإلكترونات.
تكوّن الأيون الموجب Cation Formation
يتكوّن الأيون الموجب عندما تفقد الذرة إلكتروناً واحداً أو أكثر، وعندئذ ستحمل شحنة موجبة بعدد الإلكترونات التي فقدتها، ويحدث هذا لذرات العناصر التي توجد في المجموعات، 1، و 2، و 13 من الجدول الدوري.
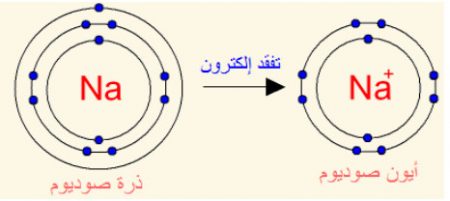
فمثلاً يتكون أيون الصوديوم Na، عندما تفقد ذرة الصوديوم (11Na) الإلكترون الموجود في مستوى طاقتها الخارجي ليصبح توزيعها الإلكترون مشابهاً لتوزيع ذرة النيون (10Ne) المستقرة الموضحة في الشكل.
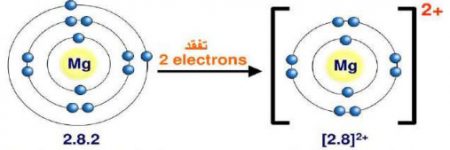
ويتكون أيون المغنيسيوم Mg، عندما تفقد ذرة المغنيسيوم (12Mg) الإلكترونين الموجودين في مستوى طاقتها الخارجي، ليصبح توزيعها الإلكترون مشابهاً لتوزيع ذرة النيون (10Ne) أيضاً الموضحة في الشكل.
أتحقق: أوضح بالرسم كيف يتكون أيون الألمنيوم الموجب.
تكوّن الأيون السالب Anion Formation
يتكوّن الأيون السالب عندما تكتسب الذرة إلكتروناً واحداً أو أكثر، وعندئذ ستحمل شحنة سالبة بعدد الإلكترونات التي اكتسبتها، ويحدث هذا لذرات العناصر التي توجد في المجموعات 15، و16، و 17 الجدول الدوري.
فمثلاً يتكون أيون الكلوريد CI، عندما تكتسب ذرة الكلور (17CI) إلكتروناً واحداً ليكتمل به مستواها الخارجي الذي يحتوي 7 إلكترونات تكافؤ، ويصبح عددها 8، وبذلك يصبح توزيعها الإلكتروني مشابهاً لتوزيع ذرة الأرجون (18Ar) المستقرة الموضحة في الشكل.
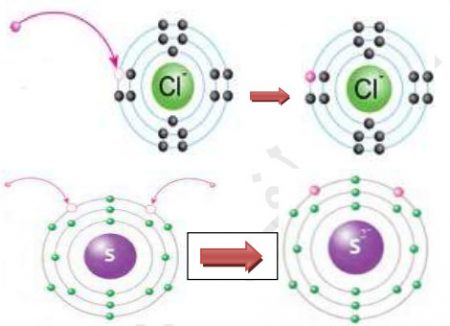
ويتكون أيضاً أيون الكبريتيد – S2، عندما تكتسب ذرة الكبريت (16S) إلكترونين ليكتمل به مستواها الخارجي الذي يحتوي 6 إلكترونات تكافؤ، فيصبح عددها 8، وعليه يصبح توزيعها الإلكتروني مشابهاً لتوزيع ذرة الآرجون (18Ar) المستقرة الموضحة في الشكل السابق.
تركيب لويس النقطي للذرات والأيونات
توصل العلماء إلى نموذج بسيط يوضح عدد إلكترونات التكافؤ للذرات أطلق عليه اسم تركيب لويس النقطي Lewis Dot Structure للإلكترونات؛ وهو عبارة عن نموذج يكون فيه رمز ذرة العنصر محاطاً بنقاط تمثل عدد إلكترونات التكافؤ.
| فمثلاً يمكن التعبير عن ذرة الصوديوم والأيون المتكون عنها باستخدام تركيب لويس النقطي على النحو الآتي: | |
| ويمكن التعبير عن ذرة المغنيسيوم والأيون المتكون عنها باستخدام تركيب لويس النقطي على النحو الآتي: |  |
| ويمكن التعبير عن ذرة الكلور والأيون المتكون عنها باستخدام تركيب لويس النقطي على النحو الآتي: |  |
| ويمكن التعبير عن ذرة الكبريت والأيون المتكون عنها باستخدام تركيب لويس النقطي على النحو الآتي: |  |
| ويمكن التعبير عن ذرة عنصر عدد إلكترونات التكافؤ لها = 5 والأيون المتكون عنها باستخدام تركيب لويس على النحو الآتي: |  |
تركيب لويس لبعض الأيونات الموجبة:
| اسم العنصر | رمزه | عدد إلكترونات التكافؤ | تركيب لويس للذرة المتعادلة | اسم الأيون المتكون | رمزه | تركيب لويس للأيون المتكون |
| الليثيوم | Li | 1 | أيون الليثيوم | |||
| البريليوم | Be | 2 |  |
أيون البريليوم | ||
| البورون | B | 3 | أيون البورون |
أتحقق: أمثل كيف يتكون أيون الألمنيوم الموجب باستخدام تركيب لويس:

تركيب لويس لبعض الأيونات السالبة:
| اسم العنصر | رمزه | عدد إلكترونات التكافؤ | تركيب لويس للذرة المتعادلة | اسم الأيون المتكون | رمزه | تركيب لويس للأيون المتكون |
| النيتروجين | N | 5 | أيون النيتريد |  |
||
| الأكسجين | O | 6 |  |
أيون الأكسيد |  |
|
| الفلور | F | 7 |  |
أيون الفلور |  |
إجابات أسئلة مراجعة الدرس ص79
س: أوضح: كيف رُتبت العناصر في الجدول الدوري في صفوف، وكيف رتبت في أعمدة؟
الإجابة:
- رتبت العناصر في صفوف بحيث تتغير خصائصها في الصف الواحد بشكل تدريجي يمكن توقعه.
- ورتبت في أعمدة بحيث تتشابه العناصر الموجودة في العمود الواحد في خصائصها الفيزيائية والكيميائية.
س: أقارن: بين المجموعة Group، والدورة Period في الجدول الدوري للعناصر.
الإجابة:
- المجموعة عمود في الجدول الدوري يحتوي على عناصر تتشابه في خصائصها الكيميائية، ويحتوي مستواها الأخير على العدد نفسه من الإلكترونات.
- الدورة صف في الجدول الدوري يحتوي على عناصر تتغير خصائصها بشكل تدريجي يمكن توقعه، وتحتوي عناصرها على عدد مستويات الطاقة نفسها.
س: أفسر: سبب استقرار العناصر الموجودة في المجموعة الثامنة من الجدول الدوري.
ج: لأن مستوى طاقتها الأخير مكتمل وممتلئ بالإلكترونات، ومن الصعب أن تفقد أن تكتسب أي إلكترون.
س: أصف: الفرق بين الذرة المتعادلة، والأيون.
الإجابة:
- الذرة المتعادلة: هي الذرة التي لا تحمل أي شحنة، وعدد البروتونات الموجودة في نواتها يساوي عدد الإلكترونات التي تدور حول نواتها.
- الأيون: هو ذرة عنصر تحمل شحنة، سواء موجبة أو سالبة، نتيجة فقدها أو اكتسابها للإلكترونات، وعدد البروتونات الموجودة في نواتها لا يساوي عدد الإلكترونات التي تدور حول نواتها.
س: أستنتج: من خلال دراستي لتركيب لويس النقطي للذرات والأيونات، أي الجمل الآتية صحيحة، وأيها غير صحيحة؟
- أ) إن عدد النيوترونات هو الذي يبين كيف تُمثل الذرة المتعادلة باستخدام تركيب لويس النقطي.
- ب) يمكن استخدام تركيب لويس للتمييز بين الذرة المتعادلة والأيون المتكون منها، وتحديده. (صحيحة)
- ج) يعبر الترميز -K عن تركيب لويس لأيون البوتاسيوم.
- د) يعبر الترميز M2 عن تركيب لويس لأيون المغنيسيوم. (صحيحة)
س: التفكير الناقد: اجتهد العلماء في البحث وإجراء التجارب المتعلقة بتصنيف العناصر في الجدول الدوري. ماذا لو اكتشف أحد العناصر الجديدة، وعلم عدده الذري بدقة، وطلب إلي تحديد موقعه في الجدول الدوري فما الذي يجب علي فعله؟
ج: يمكنني معرفة عدد الإلكترونات التي تدور حول نواة ذرته من خلال عدده ام الذري، ثم أرسم التوزيع الإلكتروني له، وأحدد عدد مستويات الطاقة التي تتوزع فيها إلكتروناته لتحديد الدورة التي يقع فيها، وأحدد عدد إلكترونات تكافؤه والتي تقع في مستوى طاقته الخارجي ! المجموعة التي يقع فيها ذلك العنصر، ثم أحدد موقعه في الجدول الدوري.
تطبيق الرياضيات:
إذا علمت أن العدد الكتلي لذرة متعادلة (لا تحمل أي شحنة) لأحد العناصر يساوي 31، وأن نواتها تحتوي على 16 نيوترون، أجد:
- عددها الذري. (15)
- إلكترونات تكافئها. (5)
- نوع شحنة الأيون الذي تكونه، وقيمتها. (3-)
- أمثل كلاً من الذرة المتعادلة لهذا العنصر، والأيون الذي تكونه باستخدام تركيب لويس النقطي؟ ج:

- أحدد الدورة التي يوجد فيها هذا العنصر، والمجموعة التي ينتمي إليها (الدورة الثالثة، والمجموعة 15)
⇐ لازلت أذكركم بمراجعة: حل أسئلة الوحدة 1 «الوراثة والتكاثر» علوم 8 أساسي «أردني» الفصل الأول