
الفهرس
الوحدة الأولى: بنية الذرة
- الدرس الأول: النماذج الذرية
- الدرس الثاني: التوزيع الالكتروني والجدول الدوري.
الوحدة الثانية: الحموض والقواعد والأملاح
- الدرس الأول: خصائص الحموض والقواعد
- الدرس الثاني: تفاعل الحموض والقواعد

الدرس الأول: النماذج الذرية
السؤال الأول: بعد دراستي للنماذج الذرية، اجيب عن الأسئلة الاتية:
س: اتتبع التسلسل الزمني للنماذج الذرية المذكورة في الدرس (السنة التي وضع فيها كل نموذج) مع ذكر اسم العالم الذي وضع كل نموذج؟
س: احتوت احدى بنود نظرية العالم دالتون على خطأ، أحدد نص ذلك البند الخاطئ وأبين الخطأ الذي ورد فيه وأصححه؟
س: كيف وصف العالم تومسون الذرة؟
س: اشرح تجربة العالم إرنست رذرفورد، وأذكر المشاهدات التي حصل عليها؟
س: علل ما يأتي:
- أ- معظم جسيمات ألفا تنفذ من خلال صفيحة الذهب بشكل مستقيم دون أن تنحرف عن مسارها؟
- ب- عدد قليل من جسيمات ألفا ينحرف عن مساره الأصلي؟
- ت- جزء قليل جدًا من جسيمات ألفا يرتد الى الخلف؟
س: عرف نموذج رذرفورد النووي؟
السؤال الثاني: بعد دراستي لتجربتي التحليل الكهربائي والتفريغ الكهربائي، اجيب عن الأسئلة الاتية:
العالم الذي قام بتجارب التحليل الكهربائي هو:
- شادويك.
- جون دالتون.
- مايكل فارادي.
- ارسطو.
أي مما يأتي لا يؤثر في خصائص الأشعة المهبطية (في تجربة التفريغ الكهربائي):
- أ- نوع صفيحة المهبط.
- ب- الغاز المستخدم داخل الأنبوب.
- ج- المجال المغناطيسي.
- د- أ + ب.
عند تعريض الاشعة المهبطية لمجال كهربائي:
- تنحرف الاشعة مبتعدة عن القطب السالب للمجال الكهربائي.
- تنحرف الاشعة مبتعدة عن القطب الموجب للمجال الكهربائي.
- ترتد الأشعة الى الخلف.
- لا يطرأ أي تغيير.
أي مما يأتي من أجزاء تجربة التحليل الكهربائي يعتبر خامل ولا يدخل في التفاعل:
- اقطاب الكربون.
- البطارية.
- المهبط.
- المصعد.
في تجربة التحليل الكهربائي لمصهور بروميد الرصاص PbBr2 تتجه ايونات البروميد السالبة نحو:
- القطب السالب (المصعد).
- القطب الموجب (المهبط).
- القطب السالب (المهبط).
- القطب الموجب (المصعد).
في تجربة التحليل الكهربائي لمصهور بروميد الرصاص PbBr2 تتحول ايونات الرصاص الموجبة الى:
- راسب بني اللون.
- غاز فضي اللون.
- غاز بني اللون.
- راسب فضي اللون.
السؤال الثالث: بعد دراستي لاكتشاف النيوترونات والنظائر اجيب عن الأسئلة الاتية:
س: ضع إشارة √ أو إشارة X؟
- العالم الذي اكتشف وجود النيوترونات في الذرة هو العالم شادويك ( )
- تبلغ كتلة الالكترون النسبية 1/1840 ( )
- تتمركز الالكترونات مع النيوترونات في نواة الذرة ( )
- في نظائر العناصر، تختلف اعداد البروتونات في الأنوية ( )
- يمتلك الكربون ثلاث نظائر ومنها نظير الكربون 12-C ( )
- من الأمثلة على الاشعة الكهرومغناطيسية اشعة بيتا ( )
س: قارن بين مفهومي النظائر والنظائر المشعة؟
الدرس الثاني: التوزيع الالكتروني والجدول الدوري
السؤال الأول: عرف ما يلي:
- الدورية:
- مستويات الطاقة:
السؤال الثاني: وزع توزيع إلكتروني للعناصر الآتية:
- وزع توزيع إلكتروني لعنصر الزرنيخ وعدده الذري 33 .
- وزع توزيع إلكتروني لعنصر انديوم وعدده الذري 49.
- وزع توزيع إلكتروني لعنصر سيزيوم وعدده الذري 55.
- وزع توزيع إلكتروني لعنصر قصدير وعدده الذري 50.
السؤال الثالث: املأ الفراغ بما يناسبه:
- أجد التوزيع الالكتروني لعنصر يقع في المجموعة السادسة والدورة الرابعة.
- أجد التوزيع الالكتروني لعنصر يقع في المجموعة الرابعة والدورة الثالثة.
- أجد التوزيع الالكتروني لعنصر يقع في المجموعة الثالثة والدورة السابعة.
- أجد التوزيع الالكتروني نصر يقع في المجموعة الثامنة والدورة الخامسة.
السؤال الرابع: رتب حجوم العناصر الآتية تصاعديًا:
- Li وعدده الذري 3.
- K وعدده الذري 19.
- Na وعدده الذري 11.
- Mg وعدده الذري 12.
- Si وعدده الذري 14.
- S وعدده الذري 16.
السؤال الخامس: أستعين بالجدول الدوري الآتي الذي يمثل عناصر افتراضية وأجيب عن الأسئلة التي تليه:
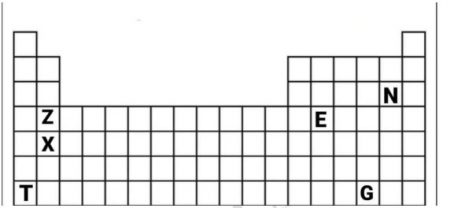
- أ- استخرج عنصر من الدورة الخامسة والمجموعة الثانية.
- ب- أي من العناصر الآتية يمثل عنصر من مجموعة الفلزات القلوية
- ج- استخرج عنصر توزيعه الالكتروني 2،8،8،2
- د- استخرج العنصر ذو الحجم الذري الأكبر.
- ه- استخرج عنصر لافلز ذو نشاط كيميائي ضعيف.
- و- استخرج عنصر من المجموعة A5.
- ي- استخرج عنصر يكون ايون احادي سالب 1-
السؤال السادس: أذكر أمثلة على كل مما يأتي
- أ- الخصائص الكيميائية والفيزيائية لعناصر المجموعة الأولى A1.
- ب- عناصر تعمل على تكوين ايون ثلاثي موجب 3+.
- ج- استخدامات الغازات النبيلة.
السؤال: أضع إشارة √ أمام العبارة الصحيحة أو X أمام العبارة الخاطئة فيما يأتي:
- الكلور هو غاز أخضر باهت اللون ( )
- من الأمثلة على عناصر المجموعة 45 عنصر ،الزرنيخ، وهو من اللافلزات ( )
- يستخدم الرصاص في صناعة الألبسة الواقية من الأشعة السينية ( )
- يدخل عنصر السيليكون في تركيب معدن الغرافيت ( )
- تكمن أهمية البورون في صناعة أواني الطبخ الزجاجية التي يمكن وضعها في الفرن أو المايكرويف ( )
⇐ وهنا كذلك: أوراق عمل لمادة العلوم الحياتية للصف التاسع «أردني» الفصل الدراسي الأول

الدرس الأول: خصائص الحموض والقواعد
السؤال الأول: عرف ما يلي:
- الحموض:
- القواعد:
- الرقم الهيدروجيني:
السؤال الثاني: عدد ما يلي:
- خصائص الحموض:
- خصائص القواعد:
السؤال الثالث: أكمل المعادلات التالية:
………….. + ………..→ HBr
…………+ …….→ KOH
…….+ …….→ Mg +HCl
……….. +………. → SO2 + H2O
السؤال الرابع: صنف الحموض والقواعد الآتية الى قوية وضعيفة:
| المركب | قوي | ضعيف |
| الأمونيا | ||
| حمض الفسفوريك | ||
| هيدروكسيد الباريوم | ||
| هيدروكسيد البوتاسيوم | ||
| حمض الكبريتيك |
السؤال الخامس: ضع إشارة (√) امام العبارة الصحيحة و (X) أمام العبارة الخاطئة
- يحل اللافلز محل ذرة الهيدروجين في الحمض ( )
- عند وضع ورقة تباع الشمس الزرقاء في المحلول الحمضي يتغير إلى اللون الأحمر ( )
- يكون المحلول متعادل عندما يكون 4=pH يكون المحلول قاعدي عندما يكون 13=pH ( )
- مثال على الكواشف الطبيعية الشاي ( )
- تعد أيونات البوتاسيوم الموجبة المسؤولة عن الخصائص الحمضية ( )
- جميع القواعد تحوي على أيون الهيدروكسيد السالب في تركيبها بعد إذابتها في الماء ( )
الدرس الثاني: تفاعل الحموض والقواعد
السؤال الأول: عرف ما يلي:
- تفاعل التعادل:
- المعادلة الايونية:
- الملح:
السؤال الثاني: أذكر حموض وقواعد تختلف في طرائق تصنيعها:
السؤال الثالث: ضع إشارة (√) أمام العبارة الصحيحة واشارة (X) أمام العبارة الخاطئة:
- يحضر حمض الكبريتيك بطريقة الدفع ( )
- يعد الأردن الدولة الثانية في العالم من حيث كميات خام الفوسفات ( )
- يعرف هيدروكسيد الصوديوم بالصودا الكاوية ( )
- حمض الفسفوريك يعرف بالنشادر ( )
- الأمونيا غاز عديم اللون يمكن إسالته بالضغط أو التبريد ( )
- يدخل حمض الكبريتيك في صناعة مواد التنظيف ( )
- تنتج الأمونيا صناعيا بطريقة هابر ( )
السؤال الرابع: بعد دراستك للأملاح اجب عما يلي:
س: املأ الفراغ بما يناسبه:
- يتألف الملح من جزئين هما: ………….
- ما الملح الذي يتكون من حمض الهيدروكلوريك ……………….
- ما الملح الذي يتكون من حمض الكبريتيك …………….
س: اكمل المعادلات التي تخص الملح الآتية:
…………..+ …………..→ HNO3 + HCl
…………+ ………..→ HCl + LiOH
السؤال الرابع: أكمل المعادلات الآتية:
……….+ …….→ HNO3 + Mg (OH2)
…………+ ………→ NaOH + HCl
………..+ ………→ HCl + Mg(OH)2